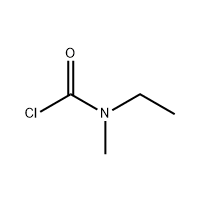
3′-Amino-2′-hydroxy-[1,1′-bipheny]-3-carbonsäure
3′-Amino-2′-hydroxy-[1,1′-bipheny]-3-carbonsäure
Als Zwischenprodukt von Eltrombopag wird 3'-Amino-2'-hydroxy-[1,1'-bipheny]-3-carbonsäure verwendet.
Eltrombopag, entwickelt von GlaxoSmithKline (GSK) im Vereinigten Königreich und später gemeinsam mit Novartis in der Schweiz, ist der erste und einzige zugelassene niedermolekulare nicht-peptidische TPO-Rezeptor-Agonist weltweit.Eltrombopag wurde 2008 von der US-amerikanischen FDA für die Behandlung der idiopathischen thrombozytopenischen Purpura (ITP) und 2014 für die Behandlung der schweren aplastischen Anämie (AA) zugelassen.Es ist außerdem das erste Medikament, das seit 30 Jahren von der US-amerikanischen FDA zur Behandlung von AA zugelassen wurde.
Im Dezember 2012 hat die US-amerikanische FDA Eltrombopag für die Behandlung von Thrombozytopenie bei Patienten mit chronischer Hepatitis C (CHC) zugelassen, sodass Hepatitis-C-Patienten mit schlechter Prognose aufgrund einer niedrigen Thrombozytenzahl mit der Interferon-basierten Standardtherapie bei Lebererkrankungen beginnen und diese aufrechterhalten können.Am 3. Februar 2014 gab GlaxoSmithKline bekannt, dass die FDA Eltrombopag die Zulassung als bahnbrechendes Arzneimittel für die Behandlung von Hämopenie bei Patienten mit schwerer chemikalienbedingter aplastischer Anämie (SAA) erteilt hat, die nicht vollständig auf die Immuntherapie ansprachen.Am 24. August 2015 hat die US-amerikanische FDA Eltrombopag für die Behandlung von Thrombozytopenie bei Erwachsenen und Kindern ab einem Jahr mit chronischer Immunthrombozytopenie (ITP) zugelassen, die nicht ausreichend auf Kortikosteroide, Immunglobuline oder eine Splenektomie ansprechen.Am 4. Januar 2018 wurde Eltrombopag in China zur Behandlung der primären Immunthrombozytopenie (ITP) zugelassen.


![3′-Amino-2′-hydroxy-[1,1'-bipheny]-3-carbonsäure Ausgewähltes Bild](http://cdn.globalso.com/jindunchem-med/image351.png)
![3′-Amino-2′-hydroxy-[1,1′-bipheny]-3-carbonsäure](http://cdn.globalso.com/jindunchem-med/image351-300x300.png)
![6-Tetra-O-acteyl-1-C-[4-chlor-3-[[4-[[(3S)-tetrahydrofu-ran-3-yl]oxy]phenyl]](http://cdn.globalso.com/jindunchem-med/0ecf55f0-300x300.jpg)